2019年《药学专业知识一》精讲考点详细介绍
《自考视频课程》名师讲解,轻松易懂,助您轻松上岸!低至199元/科!
第一章 药物与药学专业知识
精讲考点:药品分类
1、化学合成药
【定义】通过化学合成方法得到的小分子的有机或无机药物
【特点】★确定的化学结构 ★明确的药物作用和机制
2、来源于天然产物的药物
【定义】天然产物中提取的有效单体;发酵方法得到的抗生素;半合成得到的天然药物和半合成抗生素(比例最大★);
【特点】部分是以天然活性物质或抗生素为原料通过化学半合成或生物合成的方法得到的半合成天然药或半合成抗生素。
3、生物技术药物
【定义】指所有以生物物质为原料的各种生物活性物质及其人工合成类似物,以及通过现代生物技术制得的药物
【特点】包括细胞因子、重组蛋白质药物、抗体、疫苗和寡核苷酸药物等
一、药物物理配伍变化的类型
|
溶解度改变
|
某些溶剂性质不同的制剂相互配合使用时,常因药物在混合后的溶液体系中的溶解度较小而析出沉淀。包括提取、制备过程发生溶解度改变、吸附、盐析、增溶等现象。例如氯霉素注射液(含乙醇、甘油或丙二醇等)加入5%葡萄糖注射液中时往往析出氯霉素。 |
|
吸湿、潮解、液化与结块
|
①吸湿性强的药物或制剂如干浸膏、颗粒剂、乳酶生、干酵母等相互配伍,易吸湿潮解; ②能形成低共熔混合物的药物配伍,易发生液化。但樟脑、冰片与薄荷脑的液化,不影响疗效; ③散剂、颗粒剂等吸湿后又逐渐干燥会引起结块。 |
|
分散状态或粒径的变化
|
乳剂、混悬剂与其他药物配伍,分散相的粒径变粗,或聚结或凝聚而分层或析出。 |
二、药物化学配伍变化的类型
| 混浊和沉淀 | ①pH改变产生沉淀 | 由难溶性碱或难溶性酸制成的可溶性盐,其水溶液常因pH值的改变而析出沉淀,如盐酸氯丙嗪注射液与异戊巴比妥钠注射液、磺胺嘧啶钠注射液与葡萄糖注射液;水杨酸钠或苯巴比妥钠水溶液遇酸等。 |
| ②水解产生沉淀 | 如苯巴比妥钠溶液因水解反应能产生无效的苯乙基乙酰脲沉淀。硫酸锌在中性或弱碱性溶液中,易水解生成氢氧化锌沉淀。故硫酸锌滴眼剂中,常加入少量硼酸使溶液呈弱酸性,以防止硫酸锌水解。 | |
| ③生物碱盐溶液的沉淀 | 大多数生物碱盐的溶液,与鞣酸、碘、碘化钾、溴化钾或乌洛托品等相遇时,可产生沉淀。黄连素和黄芩苷在溶液中能产生难溶性沉淀。 | |
| ④复分解产生沉淀 | 无机药物之间可由复分解而产生沉淀。如硫酸镁溶液遇可溶性钙盐、碳酸氢钠或某些碱性较强的溶液时,均能产生沉淀。又如硝酸银遇含氯化物的水溶液时即产生沉淀。 | |
| 变色 |
药物制剂配伍引起氧化、还原、聚合、分解等反应时,可产生有色化合物或发生颜色变化。如含有酚羟基的药物与铁盐相遇,可使眼色变深。 ①维生素C与烟酰胺即使是干燥粉末混合也会产生橙红色。 ②多巴胺注射液与碳酸氢钠注射液配伍会渐变成粉红至紫色。 ③碳酸氢钠或氧化镁粉末能使大黄粉末变为粉红色。 ④氨茶碱或异烟肼与乳糖粉末混合变成黄色。 变色现象在光照、高温、高湿环境中反应更快。 |
|
| 产气 | 一般由化学反应引起,如溴化铵、氯化铵或乌洛托品与强碱性药物配伍,溴化铵和利尿药配伍,产生氨气;碳酸盐、碳酸氢钠与酸类药物配伍产生二氧化碳;乌洛托品与酸类或酸性药物配伍,产生甲醛。 | |
| 发生爆炸 | 由强氧化剂与强还原剂配伍而引起。如氯化钾与硫,强氧化剂与蔗糖或葡萄糖,高锰酸钾与甘油等。 | |
| 产生有毒物质 | 含朱砂的中药制剂不宜与还原性药物如溴化钠、溴化钾、碘化钠、碘化钾、硫酸亚铁等配伍。朱砂主要成份硫化汞,被还原产生游离汞。 | |
| 分解破坏、疗效下降 | 如乳酸环丙沙星与甲硝唑混合,甲硝唑的浓度下降;维生素B12和维生素C合用,维生素B12的效价显著降低;红霉素乳糖酸盐与葡萄糖氯化钠注射液配合,红霉素乳糖酸盐的效价降低。 | |
【2015年真题】配伍选择题:
【43-45】
A、药理学的配伍变化
B、给药途径的变化
C、适应症的变化
D、物理学的配伍变化
E、化学的配伍变化
43、将氧霉素注射液加5%葡萄糖注射液中,氧霉素从溶液中析出
44、多巴胺注射液加入5%碳酸氢钠溶液中主见变成粉红色
45、异烟肼合用香豆素类药物抗凝血作用增强属于什么变化。
【答案】DEA
【2017年真题】最佳选择题:
下列药物配伍或联用时,发生的现象属于物理配伍变化的是()。
A.氯霉素注射液加入5%葡萄糖注射液中析出沉淀
B.多巴胺注射液与碳酸氢钠注射液配伍后,溶液逐渐变成粉红至紫色
C.阿莫西林与克拉维酸钾制成复方制剂时抗菌疗效最强
D.维生素B12注射液与维生素C注射液配伍时效价最低
E.甲氧苄啶与磺胺类药物制成复方制剂时抗菌疗效最强
【答案】A
一、外界因素
| 温度 | Arrhenius方程描述了温度与反应速度之间的定量关系,即随着温度升高反应速度常数增大。它是药物稳定性预测的主要理论依据。 |
| 光线 | 光可以引发链反应(氧化反应)。常见的对光敏感的药物有:硝普钠、氯丙嗪、异丙嗪、核黄素、氢化可的松泼尼松、叶酸、维生素A、维生素B、辅酶Q10、硝苯吡啶等。 |
| 空气(氧) | 大气中的氧是引起药物氧化变质的重要因素。 |
| 金属离子 | 微量金属离子对自氧化反应有明显的催化作用 |
| 湿度和水分 | 空气湿度与物料含水量对固体药物制剂的稳定性有较大影响。无论是水解反应,还是氧化反应,微量的水均能加速阿司匹林、青霉素G钠盐、氨苄青霉素钠、对氨基水杨酸钠、硫酸亚铁等的分解。药物是否容易吸湿,取决于其临界相对湿度(CRH)的大小。一般水分含量在1%左右比较稳定,水分含量越高分解越快。 |
| 包装材料 | 药物贮藏于室温环境中,主要受热、光、湿度及空气(氧)的影响。包装材料与制剂稳定性的关系十分密切,特别是直接接触药品的包装材料。 |
二、处方因素
| pH的影响(液体制剂) |
①药物的水解受H+或0H-催化,故应通过试验确定最稳定pHm。 ②受H+或OH-催化水解,这种催化作用也叫专属酸碱催化或特殊酸碱催化 |
| 广义酸碱催化 |
①给出质子的物质叫广义的酸,接受质子的物质叫广义的碱。有些药物也可被广义的酸碱催化水解,这种催化作用叫广义的酸碱催化或一般酸碱催化。许多药物处方中,往往需要加入缓冲剂。 ②常用的缓冲剂如醋酸盐、磷酸盐、枸櫞酸盐、硼酸盐等,均为广义的酸碱。 |
| 溶剂的影响 |
溶剂的介电常数对离子与带电荷的药物间反应的影响可用下式表示: 根据公式 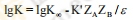 K为速度常数,ε为介电常数,K∞为溶剂ε趋向∞时的速度常数,ZAZB为离子或药物所带的电荷。 当ZAZB>0:药物离子与进攻离子的电荷相同,采用则1gK对1/ε作图所得的直线为负值,采用介电常数低的溶剂将降低药物的分解速度。苯巴比妥钠注射液用于介电常数低的溶剂,例如丙二醇(60%)可使注射液稳定性提高。 当ZAZB<0:药物离子与进攻离子的电荷相反,如专属碱催化带正电荷的药物,采取ε低的溶剂也无法提高。 |
| 离子强度影响(催化反应) |
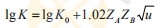 式中,K为降解速度常数;K0为溶液无限稀(μ=0)时的速度常数,μ为离子强度; ZAZB为溶液中药物所带的电荷。 当ZA、ZB>0(荷电相同)时,斜率为正值,降解速度随u的增大而增大; 当ZA、ZB<0(荷电相反)时,斜率为复值,μ增加,降解速度降低; 当ZA、ZB=0(中性药物)时,斜率为0,离子强度与降解速度无关。 |
| 表面活性剂影响:使稳定性增加(苯佐卡因加十二烷基硫酸钠);稳定性降低(聚山梨酯80使维生素D稳定性下降) | |
|
处方中基质或赋形剂的影响 |
|
以上就是关于《2019年《药学专业知识一》精讲考点详细介绍》的全部内容,如需了解更多学历提升、自考报名报考时间、自考报名流程、自考院校和专业查询、开考时间安排、自考课程、自考教材购买等的相关问题,可随时添加广东自考网《专业老师微信》进行在线沟通了解哦~
《广东自考网》免责声明:
1、由于考试政策等各方面情况的调整与变化,本网提供的考试信息仅供参考,最终考试信息请以省考试院及院校官方发布的信息为准。
2、本站内容部分信息均来源网络收集整理或来源出处标注为其它媒体的稿件转载,免费转载出于非商业性学习目的,版权归原作者所有,如有内容与版权问题等请与本站联系。联系邮箱:812379481@qq.com






















